自2021年9月1日起,我院已启用临床试验智能平台(CTMS),届时将不再进行其他任何形式的电子版资料预审。具体资料接收要求如下:
一、 备案资料
备案资料递交仍沿用线下递交形式,递交时间为会议时间(每月第一周的周二)往前推两周的周四、周五(择一)。备案资料在递交时间内无需预约。
二、 审查资料
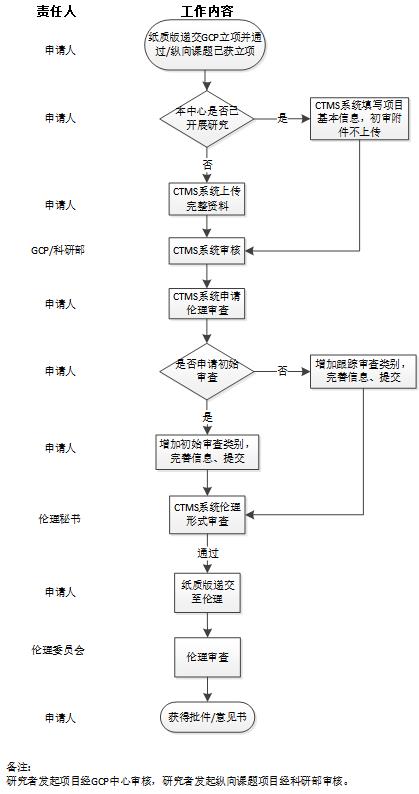
审查资料需首先登录临床试验智能平台(http://60.190.224.130:9100/igcp/#/),完成资料上传提交流程,秘书线上形式审查通过后(线上形式审查截止时间为会议时间往前推两周的周五17:00),方可递交纸质版资料至行政楼316伦理办公室。尽量选择会议时间往前推两周的周四、周五递交,截止时间同形式审查截止时间。
注意事项:
1)机构审核通过后再次登录临床试验智能平台:
①“+申请伦理审查类别”--“伦理模板”--“初始审查”,并保存。
②点击“查看子流程”:
替换上传签字或盖章后的最终版文件(包括但不限于初始审查申请表、研究者简历、研究人员列表及方案签字页等)。
补充上传研究经济利益声明签字版。(模板下载:医院官网专业版-科研工作-医学伦理-科研项目(非注册上市)初始伦理审查常用表格-AF09研究经济利益声明)
递交清单请上传可编辑版本word版。(方案、知情同意书、病例报告表及招募广告需注明版本及日期)
③确认材料齐全后,点击“保存并提交”。
④如是其他跟踪审查申请,在“+申请伦理审查类别”添加审查类型的模板。
⑤会议审查项目,需将汇报ppt附件上传至“其他”。
⑥经GCP中心和学术专家同意的项目,将“临床研究学术审查通过函”作为附件上传至“其他”。
3)电子版通过形式审查后递交与系统上传材料一致的纸质版材料1份至伦理办公室。
4)关于本院SAE、方案违背,同样使用系统递交,形式审查通过后,工作日接收纸质版审查资料(SAE报告表或方案违背报告表和递交信)
附:审查流程图

Copyright © 2022 浙江省肿瘤医院 ALLRights Reserved 浙ICP备11008795号技术支持:新慧医联
